Z najnowocześniejszego leczenia skorzystać będą mogły dzieci oraz młodzi dorośli (do 25. roku życia) chorujący na nawracającą lub oporną ostrą białaczkę limfoblastyczną (ALL) wywodzącą się z prekursorów limfocytów B.
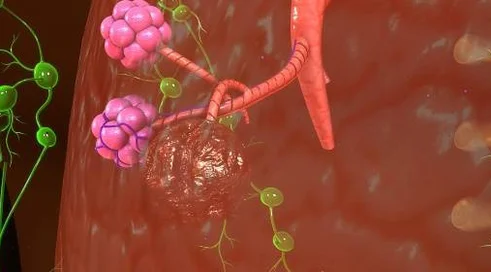
Tisagenlecleucel jest pierwszą terapią typu CAR T-cells zarejestrowaną w USA. Nie jest to lek w klasycznym rozumieniu tego pojęcia. Najprościej mówiąc – tisagenlecleucel to autologiczne (własne) limfocyty T, genetycznie zmodyfikowane w laboratorium i podane z powrotem do krwiobiegu pacjenta, gdzie namnażają się i atakują nowotwór. Leczenie tak personalizowane, jak tylko można sobie dziś wyobrazić.
Modyfikacja, jakiej poddawane są limfocyty chorego, polega na wprowadzeniu nowego genu kodującego białko CAR (chimeryczny receptor antygenowy – ang. chimeric antygen receptor). Receptor ten wiąże się ze specyficznym antygenem CD19 obecnym na powierzchni komórek nowotworowych.
Zaletą receptorów CAR jest unikatowy mechanizm rozpoznawania antygenów na komórkach nowotworowych. W przeciwieństwie do fizjologicznego receptora limfocytów T, który rozpoznaje antygen w kompleksie z białkiem MHC, CAR bezpośrednio wiąże antygeny nowotworowe w sposób niezależny zarówno od powierzchniowej ekspresji białka MHC, jak i proteosomalnej obróbki prezentowanych białek. To istotne, ponieważ komórki nowotworowe mają często obniżony poziom ekspresji MHC lub białek związanych z proteosomalną obróbką antygenów.
Skuteczność i bezpieczeństwo tisagenlecleucelu zostały wykazane w wieloośrodkowym badaniu klinicznym w udziałem 63 pacjentów (dzieci i młodych dorosłych) chorujących na ALL. Remisję w ciągu 3 miesięcy uzyskano u 83 proc. badanych.
Najgroźniejszym działaniem niepożądanym zastosowania terapii CAR T-cells może być tzw. zespół uwalniania cytokin (ang. cytokine release syndrome – CRS), przebiegający z wysoką gorączką, dreszczami i potencjalnie groźnymi dla życia zaburzeniami neurologicznymi. Do innych działań ubocznych tisagenlecleucelu zalicza się: ciężkie zakażenia, obniżenie ciśnienia krwi, ostre uszkodzenie nerek, hipoksję.
– Przekroczyliśmy kolejną granicę medycznych innowacji. Nowo zarejestrowana terapia daje możliwość przeprogramowania własnych komórek pacjenta tak, aby atakowały nowotwór. Innowacyjne terapie genowe i komórkowe mają potencjał zapoczątkować prawdziwą rewolucję w medycynie, pozwolić nam na leczenie chorób obecnie uznawanych za nieuleczalne – powiedział dr Scott Gottlieb, szef FDA.
W tym samym czasie Agencja dopuściło też do obrotu tocilizumab – preparat przeznaczony do leczenia zespołu CRS u chorych poddawanych terapii CAR T-cells.
Źródła: FDA / https://stream.wum.edu.pl