William G. Kaelin Jr., Sir Peter J. Ratcliffe i Gregg L. Semenza odkryli, w jaki sposób komórki „oceniają” dostępność tlenu i jak dostosowują swój metabolizm i funkcje fizjologiczne do zmieniających się poziomów tego życiodajnego pierwiastka. Opisali też molekularną „maszynerię”, która reguluje aktywność genów w odpowiedzi na różne poziomy tlenu.
Wszystkie komórki zwierzęce mające mitochondria nieustannie wykorzystują tlen do przetwarzania substancji odżywczych w energię. Nie mogą go jednak zgromadzić „na zapas”. Dopływ tlenu musi być stały i proporcjonalny do zapotrzebowania.
Setki milionów lat ewolucji wyposażyły nas w mechanizmy zapewniające wystarczający dopływ tlenu do tkanek i komórek. Nauka zaczęła poznawać je stosunkowo późno. W 1938 r. Corneille Heymans otrzymał Nagrodę Nobla za odkrycie, jak kłębek szyjny (niewielki „czujnik” chemiczny umiejscowiony w rozwidleniu tętnicy szyjnej) komunikuje się bezpośrednio z mózgiem, wpływając na rytm serca i akcję oddechową w odpowiedzi na zmiany stężenia tlenu i dwutlenku węgla we krwi. To jednak tylko jeden z elementów skomplikowanego systemu.
Oprócz szybkiej adaptacji do niskiego poziomu tlenu, kontrolowanej przez kłębek szyjny, istnieją też inne mechanizmy fizjologiczne – takie jak wzrost poziomu erytropoetyny (EPO), hormonu, który stymuluje produkcję czerwonych krwinek (erytropoezę). Choć o hormonalnej kontroli erytropoezy naukowcy wiedzieli już na początku XX wieku, sposób, w jaki poziom tlenu wpływał na te procesy, jeszcze długo pozostawał tajemnicą.
Gregg Semenza badał wpływ różnych poziomów tlenu na aktywność genu EPO. Wykazał, że określone segmenty DNA znajdujące się obok genu EPO pośredniczą w odpowiedzi na niedotlenienie. Sir Peter Ratcliffe prowadził podobne eksperymenty i obie grupy badawcze odkryły, że mechanizm wykrywania stężenia tlenu jest uniwersalny – obecny praktycznie we wszystkich tkankach, nie tylko w komórkach nerek, w których normalnie wytwarzana jest erytropoetyna. Następnie Semenza chciał zidentyfikować białka, które pośredniczące w reakcji komórki na tlen. W hodowli hepatocytów odkrył kompleks białkowy, który wiąże się ze zidentyfikowanym segmentem DNA w sposób zależny od tlenu. Ten kompleks nazwał czynnikiem indukowanym hipoksją (ang. hypoxia-inducible factor HIF).
W 1995 r. Semenza opublikował niektóre ze swoich kluczowych odkryć, w tym identyfikację genów kodujących HIF. Stwierdzono, że HIF składa się z dwóch różnych białek wiążących DNA, tak zwanych czynników transkrypcyjnych – HIF-1α i ARNT.
Gdy stężenie tlenu jest wysokie, komórki zawierają bardzo mało HIF-1α. I odwrotnie – przy hipoksji ilość HIF-1α wzrasta. Jak? Kilka grup badawczych wykazało, że HIF-1α, który zwykle ulega szybkiej degradacji, jest przed nią chroniony w warunkach niedotlenienia. Przy normalnym poziomie tlenu HIF-1α „znakowany” jest przez ubikwitynę i tylko z jej dodatkiem może być degradowany jest przez proteasomy. Jak ubikwityna wiąże się z HIF-1α i w sposób zależny to od tlenu?
Cennych wskazówek dostarczyły prace Williama Kaelina Jr. Badał on chorobę von Hippel-Lindau (VHL), rzadkie schorzenie genetyczna prowadzące do dramatycznie zwiększonego ryzyka zachorowania na niektóre nowotwory. Kaelin wykazał, że gen VHL koduje białko, które zapobiega wystąpieniu raka, oraz że komórki nowotworowe pozbawione funkcjonalnego genu VHL przejawiają nienormalnie wysoki poziom genów regulowanych przez hipoksję (ponownie wprowadzony do nich genu VHL normalizowało ten poziom). Wywnioskowano z tego, że białko VHL było w jakiś sposób zaangażowane w kontrolowanie odpowiedzi na niedotlenienie. Okazało się, że białko VHL jest częścią kompleksu, który znakuje białka ubikwityną, „skazując” je na degradację w proteasomach. Następnie Ratcliffe dokonał kluczowego odkrycia: wykazał, że białko VHL może fizycznie oddziaływać z HIF-1α i jest wymagane do jego degradacji przy normalnym poziomie tlenu. To jednoznacznie powiązało VHL z HIF-1α.
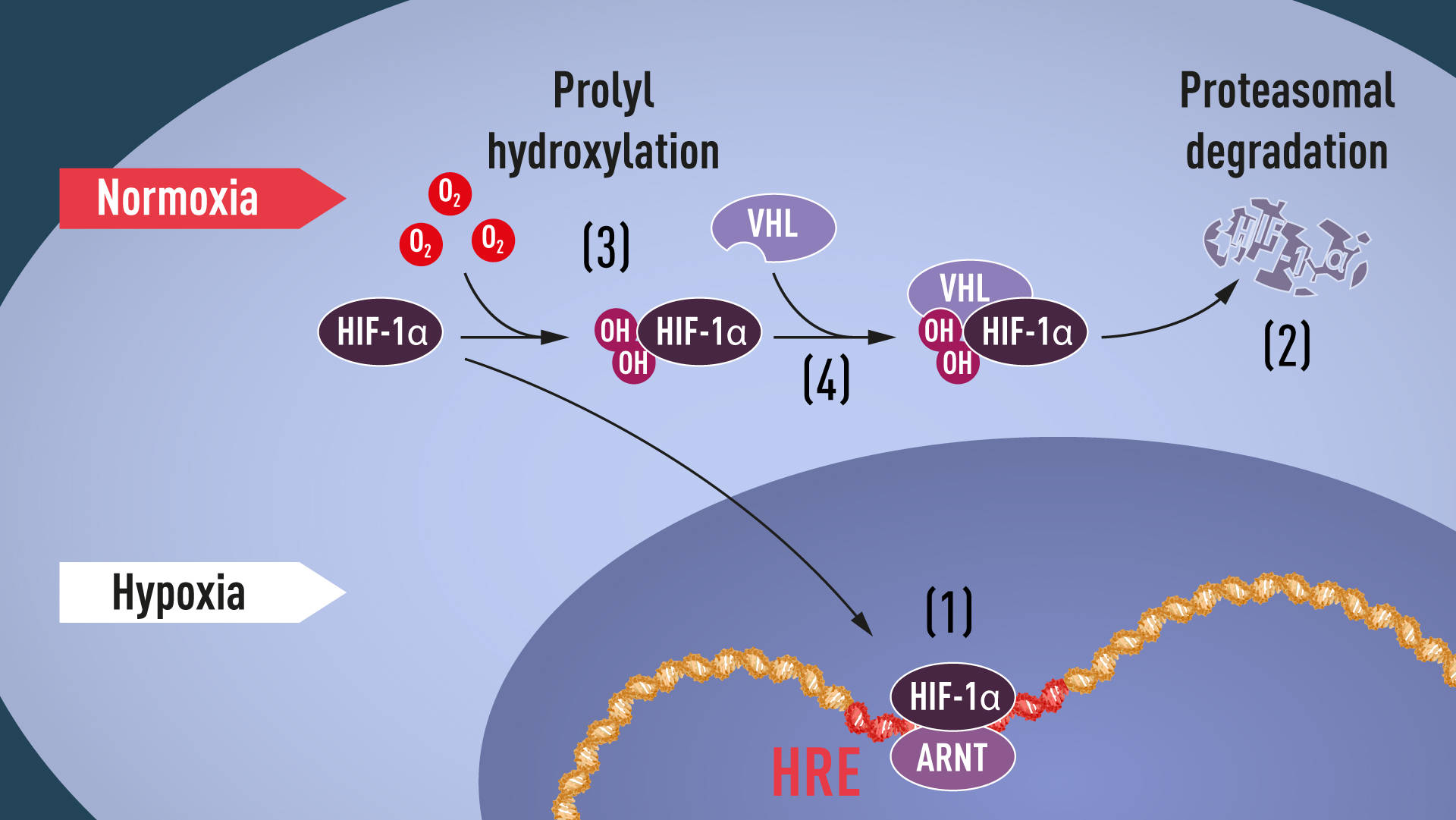
Ostatnim elementem układanki było ustalenia, w jaki sposób poziom tlenu wpływa na interakcję między VHL i HIF-1α. Poszukiwania skupiły się na konkretnej części białka HIF-1α, o której było wiadomo, że jest ważna dla degradacji zależnej od VHL. W 2001 r. Kaelin i Ratcliffe w dwóch równocześnie opublikowanych artykułach wykazali, że przy normalnym poziomie tlenu grupy hydroksylowe przyłączane są do dwóch określonych miejsc HIF-1α. Ta modyfikacja białka (prolyl hydroxylation) pozwala VHL „rozpoznawać” HIF-1α i wiązać się z nim. Wyjaśniono zatem, w jaki sposób normalne poziomy tlenu kontrolują szybką degradację HIF-1α za pomocą enzymów wrażliwych na tlen (tzw. hydroksylaz prolilowych). Dalsze badania przeprowadzone m.in. przez Ratcliffe’a pozwoliły zidentyfikować odpowiedzialne za opisany proces hydroksylazy prolilowe.
Odkrycia nagrodzonych uczonych utorowały drogę do opracowania innowacyjnych strategii walki z niedokrwistością, nowotworami i wieloma innymi schorzeniami.
William G. Kaelin Jr. urodził się w 1957 roku w Nowym Jorku. Pracuje w Harvard Medical School w Bostonie oraz w Howard Hughes Medical Institut w Chevy Chase.
Sir Peter J. Ratcliffe ma 65 lat. Urodził się w angielskim Lancashire. Pracuje na Uniwersytecie Oksfordzkim oraz we Francis Crick Institute w Londynie.
Gregg L. Semenza urodził się w 1956 r. w Nowym Jorku. Związany jest z Johns Hopkins University w Baltimore.
Każdy z laureatów otrzyma 3 mln koron szwedzkich, czyli po ok. 277 tys. euro.
Najważniejsze publikacje tegorocznych Noblistów to:
- Semenza, G.L, Nejfelt, M.K., Chi, S.M. & Antonarakis, S.E. (1991). Hypoxia-inducible nuclear factors bind to an enhancer element located 3’ to the human erythropoietin gene. Proc Natl Acad Sci USA, 88, 5680-5684.
- Wang, G.L., Jiang, B.-H., Rue, E.A. & Semenza, G.L. (1995). Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proc Natl Acad Sci USA, 92, 5510-5514.
- Maxwell, P.H., Wiesener, M.S., Chang, G.-W., Clifford, S.C., Vaux, E.C., Cockman, M.E., Wykoff, C.C., Pugh, C.W., Maher, E.R. & Ratcliffe, P.J. (1999). The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature, 399, 271-275.
- Mircea, I., Kondo, K., Yang, H., Kim, W., Valiando, J., Ohh, M., Salic, A., Asara, J.M., Lane, W.S. & Kaelin Jr., W.G. (2001) HIFa targeted for VHL-mediated destruction by proline hydroxylation: Implications for O2 sensing. Science, 292, 464-468.
- Jakkola, P., Mole, D.R., Tian, Y.-M., Wilson, M.I., Gielbert, J., Gaskell, S.J., von Kriegsheim, A., Heberstreit, H.F., Mukherji, M., Schofield, C.J., Maxwell, P.H., Pugh, C.W. & Ratcliffe, P.J. (2001). Targeting of HIF-α to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science, 292, 468-472.
Źródło: nobelprize.org