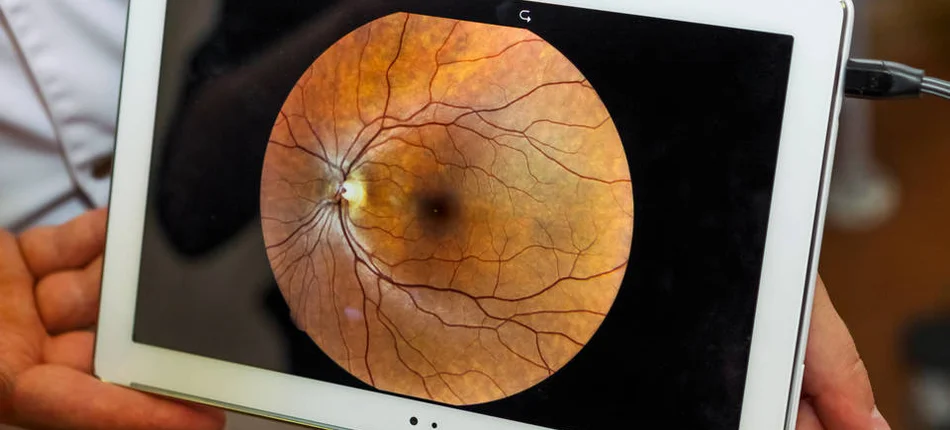
Komisja Europejska zatwierdziła farycymab do leczenia neowaskularnego (wysiękowego) zwyrodnienia plamki związanego z wiekiem (nAMD) i zaburzenia widzenia spowodowanego cukrzycowym obrzękiem plamki (DME). Te dwa schorzenia siatkówki są głównymi przyczynami utraty wzroku i występują u ponad 40 milionów ludzi na świecie. [1,2,3,4]
– Wielu chorych z nAMD i DME ma trudności z comiesięcznymi zastrzykami i wizytami lekarskimi, często związanymi z obecnymi standardami opieki, i niestety ich wzrok może ucierpieć w wyniku niedostatecznego leczenia. Dla Europejczyków zmagających się z tymi schorzeniami ta decyzja to szansa na pierwszą nową metodę leczenia od ponad dekady. Taką, która z czasem może poprawić i ochronić ich wzrok przy mniejszej liczbie zastrzyków – powiedział prof. Ramin Tadayoni, kierujący oddziałami okulistyki w paryskich szpitalach Lariboisière, Saint-Louis i Rothschild oraz prezes elekt Europejskiego Towarzystwa Specjalistów ds. Chorób Siatkówki (EURETINA).
Farycymab jest jedynym wstrzykiwanym lekiem okulistycznym zatwierdzonym w Europie na podstawie badań III fazy potwierdzających możliwość leczenia nAMD i DME w odstępach do czterech miesięcy. [5,6,7] W związku z tym, że stosowanie farycymabu może z czasem wymagać mniejszej liczby zastrzyków do oka, przy jednoczesnej poprawie i utrzymaniu jakości widzenia oraz poprawie anatomicznej, przebieg leczenia dla pacjentów, ich opiekunów i systemów opieki zdrowotnej będzie mniej uciążliwy. [6,7,8,9]
Decyzja o zatwierdzeniu leku była możliwa dzięki wynikom czterech badań fazy III, w których uczestniczyło 3220 pacjentów: TENAYA i LUCERNE w przypadku nAMD w pierwszym roku oraz YOSEMITE i RHINE w przypadku DME przez okres do dwóch lat. Badania wykazały, że osoby leczone farycymabem , podawanym w odstępach do czterech miesięcy, osiągnęły podobną poprawę widzenia i poprawę anatomiczną w porównaniu do afliberceptu podawanego co dwa miesiące. [6,7,8] Dane pochodzące z wszystkich czterech badań przeprowadzonych w ciągu dwóch lat wykazały, że u ponad 60% osób leczonych farycymabem można było zmniejszyć częstotliwość podawania leku do czterech miesięcy przy jednoczesnej poprawie wzroku i utrzymaniu jakości widzenia. Ponadto, w okresie do dwóch lat, mediana liczby zastrzyków u osób z nAMD i DME leczonych farycymabem była mniejsza o odpowiednio 33% (10 vs 15) i 21% (11 vs 14) w porównaniu z afliberceptem. [6,9]
Przeciwciało dwuswoiste farycymab zostało specjalnie zaprojektowane w celu hamowania dwóch szlaków chorobowych, powiązanych z wieloma zagrażającymi wzrokowi schorzeniami siatkówki. Poprzez niezależne blokowanie szlaków z udziałem Ang-2 i VEGF-A, farycymab stabilizuje naczynia krwionośne, a tym samym ogranicza stan zapalny, uszkodzenia i nieprawidłowy wzrost naczyń (neowaskularyzację) bardziej niż hamowanie samego VEGF-A. [7] Trwała stabilizacja naczyń krwionośnych może na dłużej poprawić kontrolowanie choroby, widzenie i wyniki anatomiczne. [7,8]
Farycymab jest obecnie zatwierdzony dla osób z nAMD i DME w Unii Europejskiej i dziewięciu innych krajach na całym świecie, w tym w USA, Japonii i Wielkiej Brytanii. Obecnie trwa składanie wniosków do innych organów regulacyjnych. [5,10,11,12] Do tej pory na całym świecie dostarczono ponad 100 tysięcy dawek farycymabu w celu leczenia tych schorzeń. [13] Roche w dalszym ciągu prowadzi badania nad obszarami, w których farycymab może przynieść dodatkowe korzyści pacjentom.
Cukrzycowy obrzęk plamki to schorzenie siatkówki występujące u około 21 milionów ludzi na całym świecie. Gdy nie jest leczone, może doprowadzić do utraty wzroku oraz pogorszenia jakości życia. [3,23] DME występuje, gdy uszkodzone naczynia krwionośne przeciekają i powodują obrzęk plamki – centralnego obszaru siatkówki odpowiedzialnego za ostre widzenie potrzebne np. do czytania i prowadzenia samochodu. [19,24] Szacuje się, że liczba osób z DME będzie rosła wraz ze wzrostem częstości występowania cukrzycy. [25]
inf pras
Bibliografia:
[1] Bright Focus Foundation. Age-Related Macular Degeneration: Facts & Figures. [Internet; dostęp: wrzesień 2022]. Dostępne pod adresem: https://www.brightfocus.org/macular/article/age-related-macular-facts-figures.
[2] Connolly E, et al. Prevalence of age-related macular degeneration associated genetic risk factors and 4-year progression data in the Irish population. Br J Ophthalmol. 2018;102:1691–5.
[3] Yau JWY, et al. Global prevalence and major risk factors of diabetic retinopathy. Diabetes Care. 2012;35:556-64.
[4] Heier JS, et al. The Angiopoietin/Tie pathway in retinal vascular diseases: a review. Retina-J Ret Vit Dis. 2021;41:1-19.
[5] Europejska Agencja Leków. Summary of Product Characteristics, Vabysmo, 2022.
[6] Wells JA, et al. Faricimab in Diabetic Macular Edema: Two-Year Results From the Phase III YOSEMITE and RHINE Trials. Zaprezentowano na: Angiogenesis, Exudation and Degeneration 2022.
[7] Heier JS, et al. Efficacy, durability and safety of intravitreal faricimab up to every 16 weeks for neovascular age-related macular degeneration (TENAYA and LUCERNE): Two randomised, double-masked, phase III, non-inferiority trials. The Lancet. 2022;399(10326):741-755, https://doi.org/10.1016/S0140-6736(22)00010-1.
[8] Wykoff C, et al. Efficacy, durability and safety of intravitreal faricimab with extended dosing up to every 16 weeks in patients with DME (YOSEMITE and RHINE): two randomised, double-masked, phase 3 trials. The Lancet. 2022;399(10326):729-740, https://doi.org/10.1016/S0140-6736(22)00018-6.
[9] Khanani A, et al. Faricimab in Neovascular Age-Related Macular Degeneration: Year 2 Efficacy, Safety and Durability Results From the Phase III TENAYA and LUCERNE Trials. Zaprezentowano na: 2022 American Society of Retina Specialists Annual Scientific Meeting; 2022.
[10] U.S. Food and Drug Administration (FDA). Highlights of prescribing information, Vabysmo. 2022. [Internet; dostęp: wrzesień 2022]. Dostępne pod adresem: https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/761235s000lbl.pdf.
[11] UK Medicines and Healthcare products Regulatory Agency approves faricimab through international work-sharing initiative. [Internet; dostęp: wrzesień 2022]. Dostępne pod adresem: https://www.gov.uk/government/news/mhra-approves-faricimab-through-international-work-sharing-initiative.
[12] Chugai Obtains Regulatory Approval for Vabysmo, the First Bispecific Antibody in Ophthalmology, for Neovascular Age-related Macular Degeneration and Diabetic Macular Edema. [Internet; dostęp: wrzesień 2022]. Dostępne pod adresem: https://www.chugai-pharm.co.jp/news/cont_file_dl.php?f=220328eVabysmo _DME_nAMD_approval.pdf&src=[%0],[%1]&rep=130,909.
[13] Dane Roche.
[14] Clinical Trials.gov. A Study to Evaluate the Long-Term Safety and Tolerability of Faricimab in Participants With Neovascular Age-Related Macular Degeneration (AVONELLE-X). [Internet; dostęp: wrzesień 2022]. Dostępne pod adresem: https://clinicaltrials.gov/ct2/show/NCT04777201.
[15] Clinical Trials.gov. A Study to Evaluate the Long-Term Safety and Tolerability of Faricimab in Participants With Diabetic Macular Edema (Rhone-X). [Internet; dostęp: wrzesień 2022]. Dostępne pod adresem: https://clinicaltrials.gov/ct2/show/NCT04432831.
[16] Clinical Trials.gov. A study to evaluate the efficacy and safety of faricimab in participants with macular edema secondary to central retinal or hemiretinal vein occlusion (COMINO). [Internet; dostęp: wrzesień 2022]. Dostępne pod adresem: https://clinicaltrials.gov/ct2/show/NCT04740931.
[17] Clinical Trials.gov. A study to evaluate the efficacy and safety of faricimab (RO6867461) in participants with macular edema secondary to branch retinal vein occlusion (BALATON). [Internet; dostęp: wrzesień 2022]. Dostępne pod adresem: https://clinicaltrials.gov/ct2/show/NCT04740905.
[18] Clinical Trials.gov. A study to investigate faricimab treatment response in treatment-naïve, underrepresented patients with diabetic macular edema (ELEVATUM). [Internet; dostęp: wrzesień 2022]. Dostępne pod adresem: https://clinicaltrials.gov/ct2/show/NCT05224102.
[19] All About Vision. Macula Lutea. [Internet; dostęp: wrzesień 2022]. Dostępne pod adresem: https://www.allaboutvision.com/resources/macula.
[20] Pennington KL, et al. Epidemiology of age-related macular degeneration (AMD): associations with cardiovascular disease phenotypes and lipid factors. Eye and Vision. 2016;3:34.
[21] Little K, et al. Myofibroblasts in macular fibrosis secondary to neovascular age-related macular degeneration-the potential sources and molecular cues for their recruitment and activation. EBioMedicine. 2018;38:283-91.
[22] Wong WL, et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Glob Health. 2014;2:106–16.
[23] Park SJ, et al. Extent of exacerbation of chronic health conditions by visual impairment in terms of health-related quality of life. JAMA Ophthalmol. 2015;133:1267-75.
[24] National Eye Institute. Facts about diabetic eye disease [Internet; dostęp: wrzesień 2022]. Dostępne pod adresem: https://nei.nih.gov/health/diabetic/retinopathy.
[25] Liu E, et al. Diabetic macular oedema: clinical risk factors and emerging genetic influences. Clin Exp Optom. 2017;100:569-76.
[26] FDA. Highlights of prescribing information, Susvimo. 2021. [Internet; dostęp: wrzesień 2022]. Dostępne pod adresem: https://www.gene.com/download/pdf/susvimo_prescribing.pdf.
[27] FDA. Highlights of prescribing information, Lucentis. 2006. [Internet; dostęp: wrzesień 2022]. Dostępne pod adresem: https://www.accessdata.fda.gov/drugsatfda_docs/label/2014/125156s105lbl.pdf.