Stwardnienie rozsiane (SM) to główna nieurazowa przyczyna niepełnosprawności wśród młodych dorosłych. Choroba często skutkuje ciężkim, trwałym inwalidztwem. Szacuje się, że na SM choruje na świecie ponad 2,3 mln osób. W Polsce ok. 45 tysięcy.
Nie wszyscy chorują tak samo. Wyróżniono cztery podstawowe typy SM, charakteryzujące się odmienną dynamiką pojawiania się i nasilania przejawów niepełnosprawności.
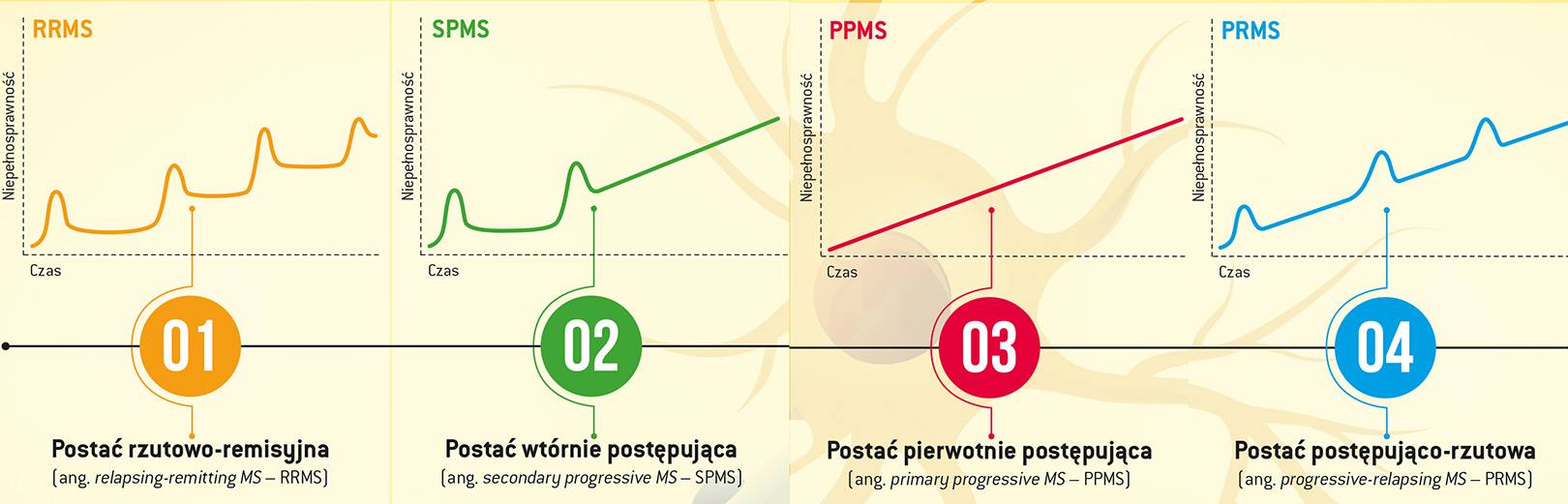
Szczególnie wyniszczająca jest postać pierwotnie postępująca (PPSM), która dotyczy 10–15 proc. chorych. Cechuje ją stopniowe nasilanie się objawów, zazwyczaj bez wyraźnych rzutów i okresów remisji. Co więcej, u chorych z PPMS niepełnosprawność narasta dwa razy szybciej niż u osób z rzutowymi postaciami choroby, co oznacza, że pacjenci ci bardzo szybko zmuszeni są do korzystania ze sprzętów wspomagających poruszanie się lub wózka inwalidzkiego oraz nie są w stanie normalnie funkcjonować, np. na rynku pracy.
Okrelizumab jest lekiem biologicznym, humanizowanym przeciwciałem monoklonalnym oddziałującym na CD20-dodatnie limfocyty B, komórki mające kluczowy udział w niszczeniu osłonki mielinowej i aksonów, co może powodować niesprawność u chorych na SM.
Badania przedkliniczne wskazują, że okrelizumab wiąże się z powierzchniowym białkiem CD20, które ulega ekspresji na określonych limfocytach B, ale nie na komórkach macierzystych ani plazmocytach, co sprzyja zachowaniu ważnych funkcji układu odpornościowego.
Jest to pierwszy taki lek, który został pozytywnie zaopiniowany przez Komitet ds. Produktów Leczniczych Stosowanych u Ludzi Europejskiej Agencji Leków (Committee for Medicinal Products for Human Use – CHMP) do stosowania u pacjentów z PPMS. Rekomendacja obejmuje także chorych z rzutowymi postaciami SM.
Decyzja CHMP została podjęta w oparciu o wyniki serii badań klinicznych. W badaniu fazy III ORATORIO obejmującym pacjentów z PPMS, okrelizumab istotnie spowalniał progresję niesprawności i redukował objawy aktywności choroby w mózgu (zmiany w MRI), w porównaniu z placebo.
Z kolei w badaniach fazy III u pacjentów z RMS – OPERA I i OPERA II, okrelizumab wykazywał w porównaniu z wysoką dawką interferonu beta-1a większą skuteczność w hamowaniu aktywności choroby, spowalniając narastanie niesprawności i istotnie redukując zmiany w MRI.
Finalna decyzja Komisji Europejskiej dot. rejestracji leku we wszystkich 28 krajach Unii Europejskiej spodziewana jest w ciągu najbliższych miesięcy.
Źródło: mat. pras.